En medio del caos de una epidemia, aquellos que sobreviven a una enfermedad como COVID-19 llevan dentro de sus cuerpos los secretos de una respuesta inmune efectiva. Los virólogos como yo buscan en los sobrevivientes pistas moleculares que puedan proporcionar un plan para el diseño de futuros tratamientos o incluso una vacuna.
Los investigadores están lanzando ensayos ahora que involucran la transfusión de componentes sanguíneos de personas que se han recuperado de COVID-19 a aquellos que están enfermos o en alto riesgo. Llamada » terapia de plasma convaleciente «, esta técnica puede funcionar incluso sin que los médicos sepan exactamente qué componente de la sangre puede ser beneficioso.
Por el trabajo pionero del primer tratamiento con suero terapéutico en 1891 (contra la difteria), Emil von Behring más tarde obtuvo el Premio Nobel de medicina. Los informes anecdóticos de la terapia se remontan a la devastadora pandemia de gripe de 1918-19 , aunque los científicos carecen de evidencia definitiva de sus beneficios durante esa crisis de salud global.
El extraordinario poder de esta inmunización pasiva ha sido tradicionalmente difícil de aprovechar, principalmente debido a la dificultad de obtener cantidades significativas de plasma de los sobrevivientes. Debido a las escasas cantidades, las infusiones de plasma agrupadas de voluntarios se reservaron para las personas más vulnerables a la infección.
Avancemos rápidamente hasta el siglo XXI, y la imagen de la inmunización pasiva cambia considerablemente, gracias a los constantes avances en medicina molecular y las nuevas tecnologías que permiten a los científicos caracterizar y ampliar rápidamente la producción de las moléculas protectoras.
Trabajadores de defensa del sistema inmunitario.
El sistema inmune de los sobrevivientes de COVID-19 descubrió cómo combatir y vencer al virus invasor SARS-CoV-2.
Los anticuerpos neutralizantes son un tipo de respuesta inmunológica de primera línea. Estos anticuerpos son proteínas que son secretadas por las células inmunes llamadas linfocitos B cuando se encuentran con un invasor, como un virus.
Los anticuerpos reconocen y se unen a las proteínas en la superficie de las partículas virales. Para cada infección, el sistema inmunitario diseña anticuerpos que son altamente específicos para el patógeno invasor particular.
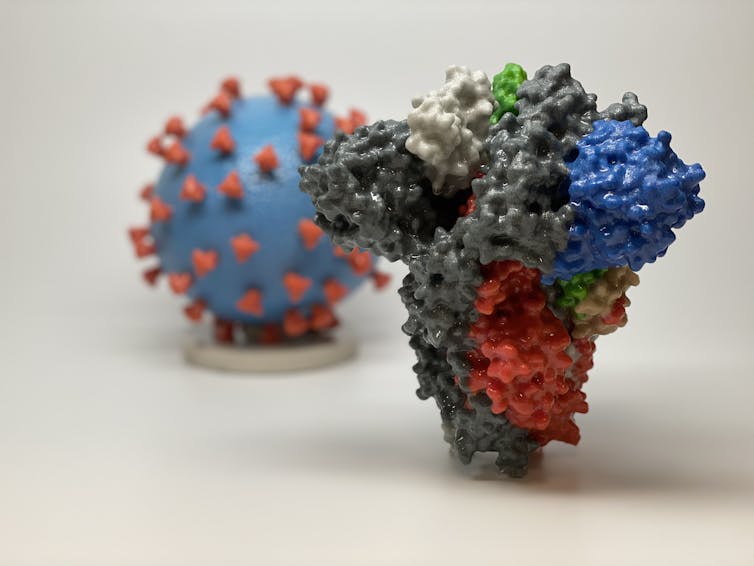
Por ejemplo, cada virus SARS-CoV-2 está cubierto por proteínas de espiga distintivas que utiliza como llaves para abrir las puertas a las células que infecta. Al atacar estos picos, imagina cubrir los surcos de una llave con cinta adhesiva, los anticuerpos pueden hacer que sea casi imposible que el virus ingrese a las células humanas. Los científicos llaman a este tipo de anticuerpos «NAbs» porque neutralizan el virus antes de que pueda entrar.
Un santo grial para los vacunólogos es descubrir cómo provocar la producción de estos ingeniosos anticuerpos. En la primera infección, sus linfocitos B se entrenan para convertirse en productores expertos de NAbs; desarrollan un recuerdo de cómo se ve un invasor en particular. Si el mismo invasor se detecta nuevamente en algún momento, sus linfocitos B veteranos (conocidos como células B de memoria en esta etapa) entran en acción. Secretan rápidamente grandes cantidades de NAb potentes, evitando una segunda enfermedad.
Las vacunas aprovechan esta capacidad, provocando de manera segura una respuesta inmune y luego confiando en la memoria del sistema inmune para poder defenderse del patógeno real si alguna vez lo encuentra.
La inmunización pasiva es un proceso en el cual los anticuerpos neutralizantes de un individuo pueden usarse para proteger o tratar a otro. Un ejemplo inteligente de este proceso explotado por la naturaleza es la leche materna, que transmite anticuerpos protectores de la madre al bebé.
Ejemplo de enfermedad por el virus del Ébola
Además de su posible papel preventivo, los anticuerpos neutralizantes están comenzando a ser beneficiosos en nuevos tratamientos para la enfermedad viral. Sin embargo, aprovechar su poder protector ha sido un desafío, principalmente porque aislar suficientes anticuerpos para ser efectivo es laborioso.
Los recientes avances en la tecnología de la medicina molecular finalmente permitieron el tipo de ampliación que permitió a los investigadores probar el principio inmunológico. En 2014-15, la enfermedad por el virus del Ébola apareció en África occidental, desencadenando una epidemia que se extendió por más de un año y mató a más de 11,000 personas . Alrededor del 40% de los infectados murieron. No hubo tratamientos ni vacunas.
En medio de la devastación llegó la innovación: ZMapp, una combinación de tres NAbs sintéticos mostró resultados prometedores tempranos en la mejora de la enfermedad en personas infectadas con EBOV .
Cuando el Ébola volvió a salir de la selva tropical, esta vez en 2018 en la República Democrática del Congo, la ciencia estaba lista. En noviembre de 2018, los médicos lanzaron tres ensayos paralelos que comparaban tres cócteles de anticuerpos diferentes. Nueve meses después, los resultados espectaculares permitieron un final inmediato de las pruebas experimentales para que los cócteles pudieran usarse en el campo.
Si bien ZMapp no funcionó tan bien como se esperaba, los ensayos identificaron otras dos terapias basadas en anticuerpos de dos compañías diferentes que suprimieron los síntomas del Ébola en pacientes infectados. Mientras más temprano en la infección los pacientes reciban terapia, mejor será la protección.
Expertos en enfermedades infecciosas en todo el mundo anunciaron los resultados como un avance vital .
En ese momento, el otoño pasado, habría sido difícil imaginar que dentro de seis meses habría una necesidad aún mayor de la poderosa estrategia de inmunización pasiva.
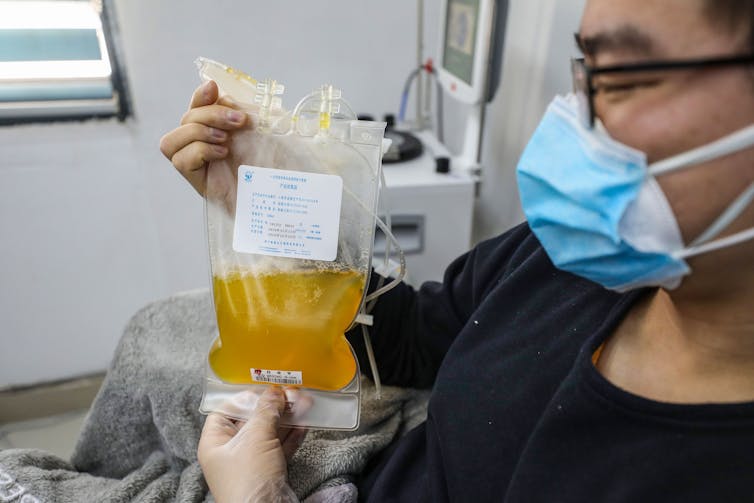
Aplicando la técnica al SARS-CoV-2
Si bien el virus SARS-CoV-2 se está moviendo rápidamente, con casi 1 millón de infecciones confirmadas en todo el mundo al momento de escribir este artículo, la ciencia está corriendo para ponerse al día.
Días atrás, un informe publicado por científicos que trabajan en Shenzhen, China, sugirió que el plasma, que contiene anticuerpos, de los sobrevivientes de COVID-19 tuvo éxito en el tratamiento de cinco pacientes críticos . A finales de marzo, la FDA aprobó el uso de plasma convaleciente en el tratamiento de personas gravemente enfermas aquí en los EE. UU. Además, Mt. Sinai en Nueva York ha establecido una colaboración con la FDA y otros hospitales para comenzar ensayos clínicos para determinar científicamente si esta estrategia de inmunización pasiva es viable.
Si bien el movimiento rápido para evaluar este novedoso tratamiento es un momento de celebración, la ciencia debe seguir avanzando. El plasma convaleciente, que se aísla de los sobrevivientes recientemente recuperados, es demasiado escaso para ser ampliamente útil. Los anticuerpos neutralizantes más potentes deben caracterizarse rápidamente y luego producirse eficientemente en grandes cantidades. Varias compañías , así como varios laboratorios académicos potentes , tienen como objetivo cumplir con el desafío de identificar y generar estos NAb que salvan vidas.
A la cabeza está Regeneron , la compañía farmacéutica que diseñó el tratamiento eficaz contra el Ébola. Aunque apunta a un virus diferente, su estrategia general sigue siendo la misma. Han aislado y caracterizado NAb y planean diseñar un cóctel de las moléculas más potentes. El objetivo viral de estos anticuerpos es la proteína espiga de SARS-CoV-2; los NAbs funcionan evitando que el virus ingrese a las células.
Los ensayos clínicos están planificados para principios del verano, esencialmente tres meses. Es un ritmo vertiginoso para el desarrollo de una herramienta de intervención tan sofisticada.
A medida que EE. UU. Entra en la fase exponencial de la propagación de COVID-19, este tratamiento no puede llegar lo suficientemente pronto.





















